神戸大学大学院医学研究科生理学分野の貝塚剛志特命助教 (現 エディンバラ大学臨床脳科学センター博士研究員)、内匠透教授 (理化学研究所生命機能科学研究センター客員主管研究員)、理化学研究所環境資源科学研究センター生命分子解析ユニットの鈴木健裕専任技師、堂前直ユニットリーダー、理化学研究所脳神経科学研究センターマーモセット神経構造研究チームの岸憲幸研究員、岡野栄之チームリーダーらの国際共同研究グループは、げっ歯類 (マウス) と霊長類 (マーモセット) のシナプスタンパク質が、生後数週間から数ヵ月、数年にわたる脳の発達期においてどのように変化するかを初めて解析し、その違いを明らかにした。さらに、自閉スペクトラム症では何が違うのかも明らかにした。本成果は、発達や疾患におけるシナプス成熟の背後にあるメカニズムに迫るものであり、治療法の開発研究に道を開くことが期待される。
この研究成果は、3月28日 (英国時間) に、「Nature Communications」に掲載されました。
ポイント
- 発達期のマウスとマーモセットのシナプスタンパク質がどのように変化するのかを明らかにした。
- マウスで生後2週齢以降に生じる変化は、マーモセットでは生後2か月以内に生じる。
- 自閉スペクトラム症 (自閉症) ※1者では健常者と比べて、シナプスタンパク質組成が未成熟な状態にある可能性が示唆された。
研究の背景
わたしたちの脳の中では多数の神経細胞がシナプスと呼ばれる接続部分を介して巨大な情報処理ネットワークを形成しています。生後の発達期においては、シナプスの数?形状?安定性などが変化していくことが知られており、これらの変化はシナプスの成熟と考えることができます (参考文献1,2)。シナプス成熟の背景には分子レベルでの変化があると思われますが、発達期にシナプスのタンパク質組成にどのような変化が生じるかについては、これまで断片的な知見しか得られていませんでした。また、マウスを含むげっ歯類と、わたしたちヒトを含む霊長類では、脳の構造や機能において、共通部分もあるものの、精神機能のような高次脳機能においては大きな違いがあるとされています。すなわち、げっ歯類と霊長類の発達期におけるシナプスの数の変化のパターンが異なることが示唆されていることから、げっ歯類と霊長類のタンパク質組成の変化を比較することは脳の進化の分子レベルでの理解に寄与すると考えられます。そこで今回、私たちはマウスとマーモセット※2の脳のシナプス後肥厚 (PSD) ※3のプロテオーム解析※4を行い、そのタンパク質組成が発達過程でどのように変化するのかを調べました。
研究の内容
はじめに2週齢, 3週齢, 6週齢, および12週齢のマウスから生化学的にPSDを精製し、分析したところ、2,186個のタンパク質が検出されました。この中には、成熟にともなって徐々に減少していくタンパク質群と増加していくタンパク質群があることがわかりました (図1a)。次に、この中から特に顕著な変動を示すタンパク質群を抽出し「減少群 (288タンパク質)」および「増加群 (267タンパク質)」と定義しました (図1b)。これらのタンパク質群にはシナプス形成などのシグナル伝達※5に関与する因子が濃縮されていることがわかりました (図1c)。実際にシグナル伝達に変化があるのかを実験的に検証したところ、Rho Family GTPase ※6シグナルが発達期に抑制されていくことがわかりました (図1d, e)。このRho Family GTPaseシグナルの変動は、発達期におけるシナプスの形状や安定性の変化に関係していると考えられます。

(b) 発達期に減少または増加を示したタンパク質群をそれぞれ「減少群」「増加群」と定義し、その相対量の変化をプロットした。黒線は平均値を示す。
(c) 減少群および増加群にどのようなタンパク質が多く含まれるかを分析した。左のグラフは濃縮のP値を、右は各群のタンパク質の中にそれぞれのパスウェイのタンパク質がどの程度含まれているかを示している。
(d) Rho Family GTPase シグナルの概略図。
(e) シナプトソーム画分におけるCofilinのリン酸化の評価。2週齢から 12週齢にかけて Rho Family GTPaseシグナルが抑制されたため、シグナル伝達下流のタンパク質リン酸化酵素 (LIMK) の活性が低下し、Cofilin のリン酸化の程度が減少したと考えられる。
次に、このタンパク質組成の変化が、遺伝子発現の変化に伴って生じているものかどうかを調べるため、脳のトランスクリプトーム※7のデータを参照しました。その結果、マウスの脳で2週齢以降に生じるPSDのタンパク質組成の変化は、2週齢以前に生じる遺伝子発現の変化とおおむね相関していることがわかりました (図2a)。この結果は、PSDのタンパク質組成の変化が遺伝子発現のレベルで制御されていること、そして遺伝子発現の変化とタンパク質レベルの変化には一定のタイムラグがあることを示唆しています。さらに、同様の遺伝子発現の変化が霊長類の脳でも見られるかを調べるため、ヒトおよびマカク猿※8の脳のトランスクリプトームデータを参照したところ、霊長類では同様の変化が出生前後に生じていることがわかりました (図2b)。このことは、遺伝子発現の変化、およびそれに伴うPSDタンパク質組成の変化のタイミングが、げっ歯類と霊長類で異なっていることを示唆しています。
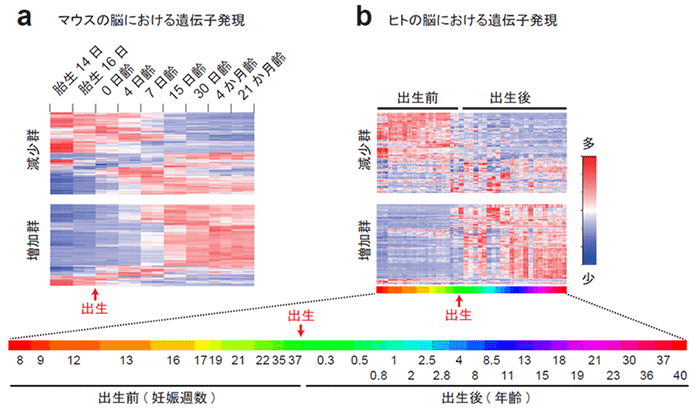
(b) 発達期のヒトの大脳皮質における遺伝子発現パターン。図1の減少群?増加群のタンパク質をコードする遺伝子のうち、発現量をそれぞれヒートマップで示した。
霊長類の脳におけるPSD組成の変化を検証するため、わたしたちは次にマーモセットのPSDのプロテオーム解析を行いました。新生児 (0か月齢)、2か月齢、3か月齢、6か月齢、および24か月齢のマーモセットのPSDを分析したところ、3,535個のタンパク質が検出されました。タンパク質の増減のパターンを分析すると、最初の2か月齢で大きな変化が生じ、その後24か月までにそれまでとは異なる変化が緩やかに生じていく、という軌跡が見られました (図3a)。マウスとマーモセットのPSDプロテオームのデータを比較したところ、2週齢のマウスのPSD組成は新生児のマーモセットと、12週齢のマウスのPSD組成は2-3か月齢のマーモセットのPSD組成と比較的類似していることがわかりました (図3b)。また、マウスの脳で2週齢から12週齢にかけて生じる変化は、マーモセットの脳で生後2か月以内に生じる変化と高い相関を示すことがわかりました (図3c)。以上の結果をまとめると、霊長類におけるシナプスのタンパク質組成は2つのフェーズに分けて解釈することができます (図3d)。げっ歯類で幼若期から成熟期にかけて生じるフェーズ1は、霊長類では生後比較的早い段階で生じ、霊長類ではその後フェーズ2の変化が生じると考えられます。このフェーズ2の変化は、霊長類特異的に観察される顕著なシナプス減少などに関与している可能性が考えられます。

(b) マウスとマーモセットのPSDタンパク質組成の相関
(c) 減少群と増加群のタンパク質のマウスにおける2週齢から12週齢までの変化とマーモセットにおける出生直後から2か月齢までの変化をプロットした。正の相関があることがわかる (スピアマン相関係数:0.71)
(d) げっ歯類と霊長類におけるPSD組成の変化のモデル図。
シナプスの発達は、自閉症をはじめとする精神疾患の病因と関連があることが知られています。自閉症者やモデルマウスの脳においては、しばしばシナプスの数や形態、安定性などに異常が見られます。これらの異常には、より若い時期に類似した、いわば「未成熟」な状態であると解釈できるものが含まれています。そこで、自閉症者の脳のトランスクリプトームデータを参照することで、PSDタンパク質組成の「未成熟性」を生じうる遺伝子発現パターンが見られないかを調べました。その結果、自閉症者の脳では発達に伴い増加するはずの遺伝子の発現が健常者より低く、減少するはずの遺伝子の発現変化が高い傾向にあることがわかりました。この結果は、自閉症者のPSDのタンパク質組成が健常者より未成熟な状態にある可能性を示唆しています。

(b) 減少群及び増加群のPSDタンパク質をコードする遺伝子の、ヒトの大脳皮質における出生前から出生後にかけての発現変化および健常者と自閉症者の発現比をプロットした。全体として負の相関があることがわかる (スピアマン相関係数:-0.49)
今後の展開
今回の研究では、発達に伴うシナプスのタンパク質組成の変化をげっ歯類および霊長類において明らかにしました。これはシナプス成熟の分子メカニズムや、げっ歯類と霊長類のシナプス成熟プロセスの違いを解明する研究に発展させていくことができると考えられます。また、これらのシナプス成熟プロセスの機構がわかることにより、自閉症をはじめとする精神疾患の病態解明につながることが期待されます。
用語解説
※1 自閉症 (自閉スペクトラム症)
自閉症は神経発達症のひとつであり、主な行動特徴として社会性コミュニケーションの低下、特定の物事への強いこだわりや繰り返し行動を示す。自閉症者では多様な種類の遺伝子変異やゲノム異常が報告されているが、未だ多くの自閉症は原因が不明である。
※2 マーモセット (コモンマーモセット)
霊長目マーモセット科 (キヌザル科) Callithrix属に分類される新世界ザルの一種。マウスよりも人間に近い実験動物として利用されることがある。
※3 シナプス後肥厚 (postsynaptic density:PSD)
シナプス後部の細胞膜の直下に存在する、多数のタンパク質が集積した構造体。神経伝達物質受容体、足場タンパク質、シグナル伝達酵素など、1,000種類以上のタンパク質から構成されている。
※4 プロテオーム解析
目的のサンプルに含まれるタンパク質を網羅的に検出する実験。サンプルに含まれるタンパク質を消化酵素で断片化してその質量を測定し、得られたデータをタンパク質のアミノ酸配列データと比較することでタンパク質を同定?定量する。
※5 シグナル伝達
細胞外または細胞内における刺激を検出し、その情報を様々なタンパク質を介して伝達しながら遺伝子発現調節やタンパク質の活性制御などを行う仕組みのこと。
※6 Rho Family GTPase
Rhoファミリーは細胞の形態を司るアクチン骨格の主要な制御因子群であり、RhoA, Rac1, Cdc42の3種類のタンパク質を含む。神経細胞においては、シナプスの後部をになう樹状突起棘 (スパイン) の形状の制御において重要な役割を果たしている。
※7 トランスクリプトーム
特定の状況下において細胞中に存在する全てのメッセンジャーRNA (mRNA) の総体を指す呼称。DNAに保存されている遺伝情報がmRNAに写し取られ (転写) それをもとにタンパク質を作る (翻訳) という一連の過程を遺伝子発現とよぶ。
※8 マカク猿
霊長目オナガザル科マカク属に分類されるサルのこと。
参考文献
- Forrest MP, Parnell E, Penzes P. Dendritic structural plasticity and neuropsychiatric disease. Nat Rev Neurosci [Internet]. 2018;19(4):215–34. Available from: 10.1038/nrn.2018.16
- Berry KP, Nedivi E. Spine Dynamics: Are They All the Same? Neuron [Internet]. 2017;96(1):43–55. Available from: 10.1016/j.neuron.2017.08.008
謝辞
本研究は、日本学術振興会科学研究費補助金 (学術変革領域研究 (A) 臨界期生物学、基盤研究 (S)) 、科学技術振興機構ムーンショット型研究開発事業?目標9、武田科学振興財団特定研究助成などによる支援を受けて行いました。
論文情報
タイトル
“Remodeling of the postsynaptic proteome in male mice and marmosets during synapse development”
DOI
10.1038/s41467-024-46529-9
著者
Takeshi Kaizuka1,2*, Takehiro Suzuki3*, Noriyuki Kishi1, Kota Tamada1,2, Manfred W. Kilimann4, Takehiko Ueyama5, Masahiko Watanabe6, Tomomi Shimogori1, Hideyuki Okano1,7, Naoshi Dohmae3, Toru Takumi1,2,8,9
1 RIKEN Brain Science Institute
2 Department Physiology and Cell Biology, Kobe University School of Medicine
3 Biomolecular Characterization Unit, RIKEN Center for Sustainable Resource Science
4 Max Planck Institute for Experimental Medicine
5 Laboratory of Molecular Pharmacology, Biosignal Research Center, Kobe University
6 Department of Anatomy, Faculty of Medicine, Hokkaido University
7 Department of Physiology, Keio University School of Medicine
8 RIKEN Center for Biosystems Dynamics Research
9 Lead Contact
*These authors equally contributed to the work掲載誌
Nature Communications