神戸大学大学院農学研究科のアクタ アヤシャ (博士後期課程) と理化学研究所環境資源科学研究センター高橋聡史 (テクニカルスタッフ) らは、ハクサイにおいて、遺伝子発現調節に重要なヒストンの化学修飾※1のうちの一つ (H3K27me3) の役割を明らかにしました。さらにこれが、アブラナ科葉根菜の商品価値に直接的な影響を及ぼす春化※2に関わる遺伝子の発現を制御する役割をもっていることも明らかにしました。
本研究は、神戸大学大学院農学研究科の藤本龍准教授ら、理化学研究所環境資源科学研究センター関原明チームリーダーら、オーストラリア連邦科学産業研究機構 (CSIRO) らの研究グループにより行われました。
この研究成果は、2019年10月17日 (イギリス時間) に、DNA Researchにオンライン掲載されました。
ポイント
- ハクサイの遺伝子発現調節に重要なヒストン化学修飾の一つであるヒストンH3の27番目のリジン残基のトリメチル化 (H3K27me3) の役割を明らかにした。
- H3K27me3は遺伝子の発現抑制、および遺伝子の組織特異的な発現調整に重要である。
- ハクサイの春化の鍵遺伝子として知られているFLOWERING LOCUS C (FLC) の発現抑制にH3K27me3が重要な役割を担っている。
研究の背景
DNA配列が同じ遺伝子を持つ個体間や同一個体内であっても、その遺伝子の発現レベルには違いが見られることが知られています。例えば、植物の同じ個体においても、葉、根、花といった異なる組織では、異なった遺伝子群が発現しています。この場合、各組織のDNA塩基配列は同じであることから、DNA配列以外の情報によって遺伝子発現が制御されていることになります。このようなDNA配列に依存しない遺伝子の発現制御はエピジェネティック※3な制御とよばれています。エピジェネティックな修飾として、DNAメチル化やヒストンの化学修飾等が知られています。近年、DNA配列を決定する技術が発達しており、多くの生物種で全ゲノムDNA配列の解読が行われています。これに伴い、ゲノム全体のエピジェネティックな修飾パターン (ゲノムに対しエピゲノム※4と呼ぶ)も、様々な生物種で明らかにされています。
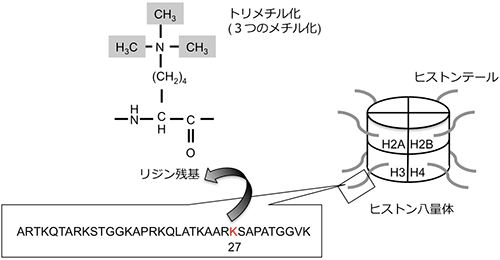
本研究の研究対象であるハクサイ (Brassica rapa L.) の全ゲノムDNA配列は2011年に決定されました。ゲノム全体のDNAメチル化状態については既に報告がありますが、ヒストンの化学修飾であるH3K27me3 (図1) のゲノム全体での修飾状態については報告がありませんでした。また、H3K27me3は、春化機構においても重要な役割を担っていることが明らかになっています。
研究の内容
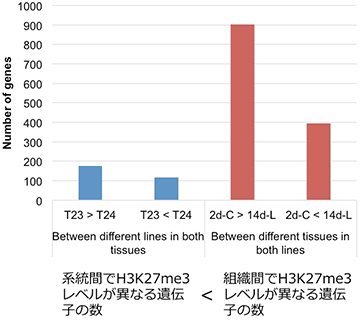
T23とT24は系統名を表す。2d-Cと14d-Lは組織名を表す。
ハクサイの2系統について、それぞれ二つの組織からサンプルを用意し、合計4種類のサンプルについて、ゲノム全体でのH3K27me3の修飾状態を明らかにしました。そして、この修飾状態について、同一組織のデータを用いて系統間の比較を行いました。同様に、同一系統内で、異なる組織のデータを比較しました。その結果、組織間ではH3K27me3の修飾に違いが見られる遺伝子が多数あることを発見しました (図2)。
次に、H3K27me3の有無と遺伝子発現量との関係について調べました。2系統、2つの異なる組織、全てのサンプルでH3K27me3の修飾を持つ遺伝子 (~8,000遺伝子) の発現量の平均値と、全遺伝子 (~40,000遺伝子) の発現量の平均値を比較しました。その結果、H3K27me3の修飾を持つ遺伝子の方が、発現量が低くなりました (図3)。このことは、H3K27me3の修飾は遺伝子発現を抑制する役割があることを示します。さらに、H3K27me3の修飾を持つ遺伝子は、様々な組織で発現レベルが変化する (組織特異的な遺伝子発現を示す) 傾向にあることも明らかになりました (図4)。
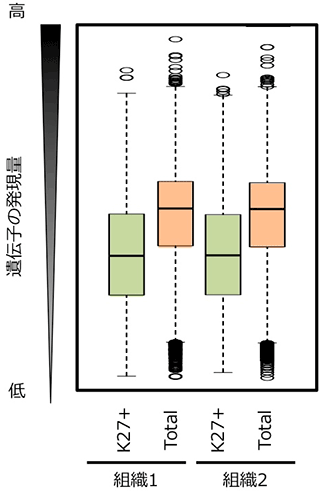
K27+はH3K27me3をもつ遺伝子を、Totalは全遺伝子を示す。
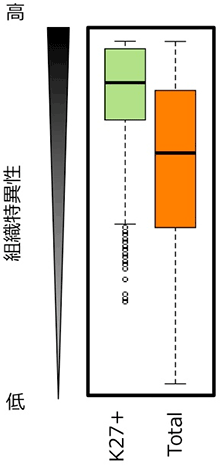
K27+はH3K27me3をもつ遺伝子を、Totalは全遺伝子を示す。
モデル植物であるシロイヌナズナと今回の研究で用いたハクサイは同じアブラナ科で、比較的近縁な関係にあります。そのため、2つの種間で相同な機能を持つ遺伝子 (種が分化する前は同一であった遺伝子) セットが存在します。この遺伝子セットについて、それぞれの種でH3K27me3の修飾状態を比較したところ、およそ40%の遺伝子が2つの種でH3K27me3の修飾を持つことが明らかとなりました。このことから、H3K27me3の修飾は、種が分化した後も保存されていることが示されました。これは、このH3K27me3の役割が両方の種において重要であることを示します。
最後に、ハクサイとシロイヌナズナを用いて、4週間の低温処理 (4℃) 前後におけるH3K27me3の修飾の変化について調べました。その結果、ゲノム全体では大きな変化は見られませんでした。一方で、春化の鍵遺伝子であるFLCでは、両方の種で、低温処理後にH3K27me3の蓄積が見られました。ハクサイの結果を見てみると、4週間の低温処理後にH3K27me3の蓄積がFLCの転写開始点付近に見られ、その後、通常温度 (22℃) に戻すと、H3K27me3の蓄積がFLC全体に広がっていました (図5)。ハクサイの花成誘導は、開花抑制遺伝子であるFLCの発現が低温により抑制され、低温処理後に温度が高くなっても発現が抑制された状態が維持されることで起こります。この現象は、H3K27me3の蓄積パターンと連動しています。つまり、FLC遺伝子の転写開始点付近にH3K27me3が蓄積することでFLC遺伝子の発現が抑制され、その後通常温度に戻った際に、H3K27me3の蓄積が遺伝子全体に広がることで、低温処理後もFLC遺伝子の発現抑制が維持されるものと考えられます。
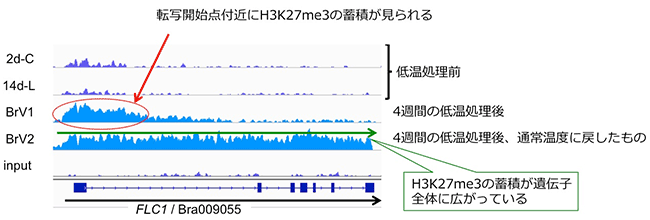
BrFLC1について示した。他のBrFLC2、BrFLC3、BrFLC5でも同様の結果が得られている。
本研究から、ハクサイにおいて、H3K27me3は遺伝子の発現抑制や組織特異的な遺伝子発現、さらには、春化によるFLCの遺伝子発現制御に重要な役割を示すことが明らかになりました。
今後の展開
今回の研究から、ハクサイにおけるH3K27me3修飾のゲノム全体での役割が明らかになりました。今後は個別の遺伝子におけるH3K27me3の役割や、植物の形質への関わりを明らかにすることで、ハクサイの農業形質との関連性等について詳細に調べたいと考えています。また、FLC遺伝子へのH3K27me3の修飾を人為的に制御することで春化への応答性を改変できれば、植物の花成誘導のタイミングを制御できる可能性があります。
用語解説
※1 ヒストンの化学修飾
ヒストンは核に存在するタンパク質で、4種類のコアヒストン (H2A、H2B、H3、H4) によってヒストン8量体を形成する。このヒストン8量体にDNAが巻き付いて、ヌクレオソームと呼ばれる染色体の最小単位を形成する。そして、複数のヌクレオソームがクロマチン構造を形成する。ヒストンの特定のリジン残基がアセチル化やメチル化され、クロマチン構造が変化し、遺伝子の発現が活性化されたり、抑制化されたりすることをヒストンの化学修飾という。
※2 春化
長期間の低温に遭遇することによって花成が誘導されること。
※3 エピジェネティック
DNAの塩基配列変化を伴わず、染色体の変化から生じる安定的に継承される遺伝子発現や形質のこと。
※4 エピゲノム
DNAの塩基配列変化を伴わない遺伝情報のこと。DNAメチル化やヒストンの化学修飾、非コードRNA、クロマチンの高次構造などを含んだ、遺伝子の働きを定める情報。
謝辞
本研究は、以下の支援を受けて行われました。
- 文部科学省科学研究費新学術領域研究(研究領域提案型)『生命科学系3分野支援活動』「ケ?ノム支援」
- 日本学術振興会 二国間共同研究事業
- 日本学術振興会 国際共同研究加速基金
- 日本学術振興会 科学研究費 新学術領域 (24113509, 18H04791, 18H04705)
- 日本学術振興会 科学研究費 若手B (2478002)、若手A (15H05614)
論文情報
タイトル
DOI
10.1093/dnares/dsz021
著者
Ayasha Akter+, Satoshi Takahashi+, Weiwei Deng+, Daniel J. Shea, Etsuko Itabashi, Motoki Shimizu, Naomi Miyaji, Kenji Osabe, Namiko Nishida, Yutaka Suzuki, Chris A. Helliwell, Motoaki Seki, William James Peacock, Elizabeth S. Dennis, Ryo Fujimoto
+ These authors equally contributed to this work掲載誌












