神戸大学大学院理学研究科の加藤大貴助手 (元Wageningen大学博士研究員)、石崎公庸教授と、Wageningen大学?Dolf Weijers教授、京都大学?河内孝之教授と西浜竜一准教授、ALBAシンクロトロン?Roeland Boer博士らの研究グループは、植物ホルモンの1種であり、植物の発生?成長?環境応答の多くを制御するオーキシン※1に対する応答機構の基本原理を明らかにしました。従来のモデル植物では高度な遺伝子重複のためその解明は容易ではありませんでしたが、陸上植物に共通かつ最小のオーキシン応答機構をもつ基部陸上植物ゼニゴケ※2を用いることで、オーキシン依存的に遺伝子発現を活性化する因子と、競合的に働く抑制因子によって感度が調整されるという仕組みがオーキシン応答の根底にあることを見出しました。また、これらの因子の分布パターンの違いにより、オーキシン応答性の異なる発生ゾーンが作られることが示唆されました。今後この成果をベースに、より複雑なオーキシン応答機構をもつ農作物などにおける仕組みを解析することで、植物の成長や形態を効率的に制御する技術につながると期待されます。
この研究成果は、2020年5月15日 (英国現地時間) に、国際学術誌Nature Plantsに掲載されました。
ポイント
- 既存のモデル植物の中で最も単純なオーキシン応答機構をもつコケ植物ゼニゴケを用いて3種類 (A, B, C) のARFタンパク質の機能の違いを解析した。
- A-ARFがB-ARFと標的遺伝子を共有する一方で、C-ARFとは共有しないことを発見した。
- 転写を活性化させるA-ARFとは対照的にB-ARF, C-ARFは転写を抑制することを示した。
- B-ARF、C-ARFがオーキシン非依存的に機能する可能性を示した。
- A-ARFのC末端領域の機能としてこれまで知られていたオーキシン応答性以外に、A-ARF同士で結合する多量体化能が重要であることを発見した。
- 以上の結果からオーキシン応答における3種類のARFタンパク質の機能についての最小モデルを提唱した。
研究の背景
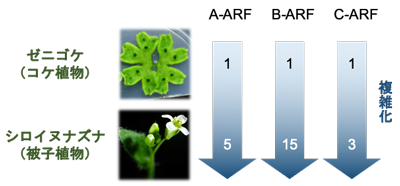
数字はシロイヌナズナ、ゼニゴケにおけるA-ARF、B-ARF、C-ARFの遺伝子数を示す
植物ホルモンの1種であるオーキシンは細胞の分裂?分化?伸長を介して、根や葉などの器官発生、光?重力?水分の方向に応じた伸長、果実の成熟など、植物の発生と成長のほぼ全てに関与する重要な因子です。そのため除草剤や挿し木の発根促進、果実の品質管理など農業的にも広く利用されています。オーキシンは植物の細胞内において受容され、AUXIN RESPONSE FACTOR (ARF) と呼ばれる一群のタンパク質が標的遺伝子の転写を活性化することで様々な応答を引き起こすことが知られています。
これまでの研究の多くはシロイヌナズナ※3という被子植物をモデルに行われてきました。被子植物のオーキシン応答機構は非常に複雑化しており、例えばシロイヌナズナでは23種類のARFタンパク質が存在しています。ARFタンパク質は系統的に3クラス (A, B, C) に分類されることがわかっていますが、被子植物のような複雑なモデルではそれぞれのグループ内でも機能の特殊化が起きていると考えられ、単独の遺伝子の機能を調べただけでは背景にある共通原理を理解することはできません。そこで本研究では陸上植物進化の基部に位置するコケ植物ゼニゴケに着目して研究を行いました。ゼニゴケはA, B, Cそれぞれ1種類ずつのみで構成された、陸上植物に共通かつ最小のオーキシン応答機構をもっており (図1)、そのためオーキシン応答機構が複雑化する前の祖先的な状態に近いと考えられています。
研究の内容
これまでの研究からゼニゴケのオーキシン応答において、A-ARFに分類されるARF1が主要な転写活性化因子として働くことがわかっていました。本研究ではまずB-ARF (ARF2)、C-ARF (ARF3) が ARF1と機能的に重複するかどうかを調べるため、arf1変異体にARF2、ARF3を導入するプロモータースワップ実験を行いました。その結果ARF2、ARF3はarf1変異体を相補することができず、異なるタンパク質機能をもつことが明らかになりました。
ARFタンパク質はDNA結合領域 (DBD)、中間領域 (MR)、相互作用領域 (PB1) の3つに分けることができます (図2a)。ゼニゴケARFタンパク質の機能の違いが何に由来するのかを調べるため、ARF1タンパク質の一部を ARF2、ARF3と入れ替えたキメラタンパク質をarf1変異体に導入するドメインスワップ実験を行いました (図2b)。その結果ARF2由来のDBDをもつARF211ではarf1変異体をある程度相補できたのに対し、ARF3由来のARF311では相補することができませんでした (図2c)。このことはDBDの機能においてARF1とARF2は近い性質をもつ一方で、ARF3は異なる機能をもつことを示唆しています。この仮説は、arf1、arf3変異体を用いたトランスクリプトーム解析や、DBDの結晶構造解析の結果からも支持されました。
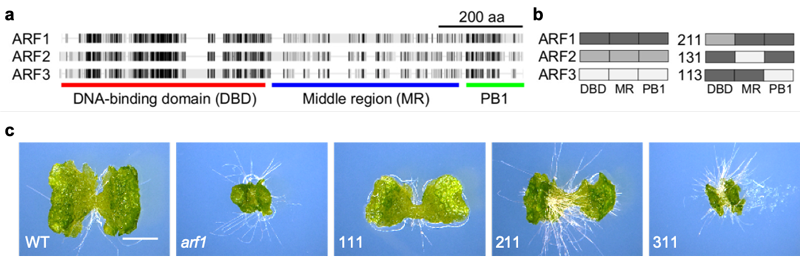
(a) ゼニゴケARFタンパク質の構造。黒い領域は相同性が高いことを示す
(b) ドメインスワップ実験の様式図
(c) DBDを入れ替えた場合の結果。
スケールバー: 2mm
MRはARFタンパク質が転写活性化因子として働くか、逆に抑制因子として働くかを決める制御領域であると考えられています。ドメインスワップ実験の結果、転写活性化因子として働くARF1とは対照的に、ARF2、ARF3のMRは転写抑制能をもつことが示唆されました。ARFタンパク質同士でアミノ酸配列を比べた時、MRにはほとんど保存性がありません (図2a)。本研究チームは様々な植物種のARFをクラスごとに比べることで、3つのアミノ酸を中心とする短い配列がクラス毎に保存されていることを見出しました。さらに遺伝学?生化学的な解析からこの配列がARF2、ARF3の転写抑制能に重要であることを明らかにするとともに、TPLという転写抑制因子と結合することを明らかにしました。
PB1はオーキシン依存的に分解されるAux/IAAという抑制因子と結合することで、ARFタンパク質にオーキシン応答性を与えています。またPB1は自分自身とも結合する多量体化能もあることが知られていましたが、その生物学的な意義は明確ではありませんでした。そこでドメインスワップ実験において、全く異なるタンパク質由来の多量体形成ドメインをPB1の代わりに融合する実験も加えました。その結果、ARF2、ARF3タンパク質の機能はオーキシンに依存しないこと、ARF1の機能にとって自分自身と結合する多量体化能が必要であり、この能力がARF3には欠けていることを明らかにしました。
ARF3はオーキシン応答に重要なARF1とは異なる標的を制御し、その機能がオーキシンに依存しないという上の結果から、本研究チームは少なくともゼニゴケにおいてC-ARF (ARF3) はオーキシン応答と直接の関係はないと結論づけました。そしてA-ARFとB-ARFは標的遺伝子への結合において競合しており、A-ARFがオーキシン依存的に転写を活性化するのに対し、B-ARFがオーキシンとは独立して転写を抑制することで細胞のオーキシン応答性を調節しているというモデルを提唱しました (図3a)。このモデルを検証するため、まずARF1、ARF2の過剰発現株を作成してオーキシン応答性を調べるとともに、生化学的な手法によりARF1とARF2が同じ標的DNAに対して同程度の結合力を持つことを明らかにしました。さらに蛍光タンパク質をARF1、ARF2に融合することで、それぞれのタンパク質の蓄積パターンが細胞によって異なるということを明らかにしました (図3b)。このことから、競合的に働くA-ARFとB-ARFの蓄積レベルに応じてオーキシン応答性が規定され、それに依存して発生ゾーンが形成されうることが示唆されました。
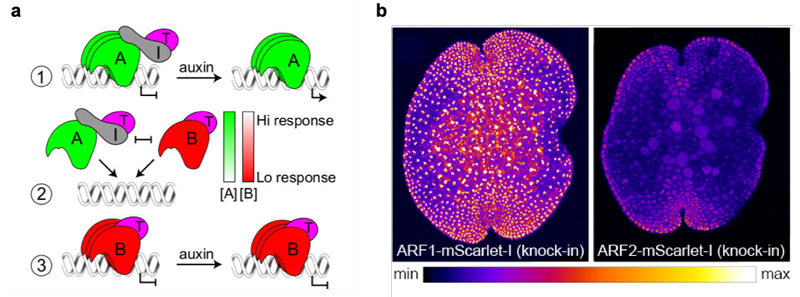
(a) オーキシン応答の最小モデル。
① 低オーキシン条件の時はA-ARF(A) がAux/IAA(I) とTPL(T) を標的遺伝子領域へ誘導し転写を抑制する。高オーキシン条件になると(I)は分解され(A)が転写を活性化する。
② (A) とB-ARF(B)は同じ標的遺伝子への結合において競合し、両タンパク質の蓄積比がオーキシン応答性を決定する。
③ (B) はオーキシン非依存的に (T) を誘引して転写を抑制する。
(b) ARF1もしくはARF2に蛍光タンパク質 (mScarlet-l) を融合したタンパク質を発現するゼニゴケの無性芽。
蛍光の強度に沿って擬似的に色づけしてある。
今後の展開
オーキシンは植物の成長と発生のほぼ全てに関わる重要なホルモンであり、農業?園芸にも広く活用されています。今後は私たちが明らかにしたシンプルなオーキシン応答モデルを基礎に、より複雑な植物種におけるオーキシン応答機構を解明することで、植物の成長や形態をより効率的にコントロールする技術へとつながると期待されます。
用語解説
- ※1 オーキシン
- 植物ホルモンの一つ。主な天然オーキシンは、インドール-3-酢酸。植物の胚発生、根?葉?花などの器官形成、果実の発達、光や重力に対する屈性反応など、植物の成長?発生?環境応答を調節する。
- ※2 ゼニゴケ
- コケ植物タイ類に属する (学名 Marchantia polymorpha)。2017年に全ゲノム配列が解読され、実験室での培養や遺伝子改変が容易などの理由から、新たなモデル植物として注目される。
- ※3 シロイヌナズナ
- 被子植物アブラナ科の一年草 (学名 Arabidopsis thaliana)。2000年に全ゲノム配列が解読され、モデル植物として植物研究の材料に広く使われている。
謝辞
本研究はWageningen大学を中心に、京都大学、ALBAシンクロトロン、神戸大学の協力により、以下の研究助成を受けて行われました。
- EMBO Long-term Fellowship (No. ALTF 415-2016)
- Netherlands Organization for Scientific Research VICI grant (No. 865.14.001)
- Ministry of Economy and Competitiveness of the Spanish Government (No. BIO2016-77883-C2-2-P, FIS2015-72574-EXP) (AEI/FEDER,EU)
- Netherlands Organization for Scientific Research ALW-open grant (No. ALWOP.402)
- JSPS科研費 (No. 19K23751, 18J12698, 19K016166, 17H06472, 18H04836, 25113009, 15K21758, 19H05675)
- 京都大学SPIRITS 2017
論文情報
- タイトル
- “Design principles of a minimal auxin response system”
- DOI
- 10.1038/s41477-020-0662-y
- 著者
- Hirotaka Kato1,5, Sumanth K. Mutte1,*, Hidemasa Suzuki2,*, Isidro Crespo3,*, Shubhajit Das1*, Tatyana Radoeva1*, Mattia Fontana1,4*, Yoshihiro Yoshitake2, Emi Hainiwa2, Willy van den Berg1, Simon Lindhoud1, Kimitsune Ishizaki5, Johannes Hohlbein4, Jan Willem Borst1, D. Roeland Boer3, Ryuichi Nishihama2, Takayuki Kohchi2 and Dolf Weijers1,#
1 Wageningen大学 Laboratory of Biochemistry
2 京都大学大学院生命科学研究科
3 ALBA シンクロトロン
4 Wageningen大学 Laboratory of Biophysics
5 神戸大学大学院理学研究科
* Equal contribution
# Corresponding author - 掲載誌
- Nature Plants