神戸大学大学院医学研究科生理学分野の 内匠 透 教授 (理化学研究所生命機能科学研究センター客員主管研究員)、Chia-Wen Lin研究員らの国際共同研究グループは、特発性自閉症*1の原因が胎児の時の造血系細胞のエピジェネティック*2な異常であり、その結果が脳や腸に見られる免疫異常であることを明らかにしました。
今後、自閉症の病態分類が進むことで、自閉症をはじめとする神経発達症*3の新たな治療戦略の創出が期待されます。
この研究成果は、5月2日 (英国時間) に、Molecular Psychiatryに掲載されました。
ポイント
- 自閉症モデル動物であるBTBRマウス*4において、AGM*5血球系細胞の一細胞RNA-seq*6解析により、免疫異常の病因としてHDAC1*7を同定した。
- 卵黄嚢*8血球系細胞の一細胞RNA-seq解析により、ミクログリア*9発達異常の病因として同じくHDAC1を同定した。
- 胎児期にHDAC活性を調節することにより、BTBRマウスの脳内炎症と免疫調節不全を改善した。
- 腸内環境、特に免疫系の変化がBTBRマウスの腸内細菌叢*10の異常をもたらすことを明らかにした。
研究の背景
自閉症 (自閉スペクトラム症) は患者数が急増しているにもかかわらず、未解明な部分の多い発達神経症です。免疫異常は、現在においては、さまざまな疾患の原因と考えられますが、自閉症の発症においても重要な役割を果たしています。脳内炎症や末梢免疫系の障害は、自閉症患者において頻繁に観察されます。さらに、免疫異常は腸内細菌叢の異常を併発し、これも脳腸軸*11を介して発症に関与していると考えられています。しかし、これらの免疫異常の背後にある本質的なメカニズムは、まだ解明されていません。
自閉症発症における免疫障害の重要な発達段階と免疫系の広範な関与を考慮し、研究チームは共通の病因が広範な免疫調節不全の根底にあり、異なるタイプの前駆細胞にあると仮定しました。免疫細胞のもとになる血球系細胞に注目、さらに、胎児の時の造血に関わる卵黄嚢 (YS) と大動脈-生殖腺-中腎 (AGM) に焦点をあてて解析を行いました。これらの結果は、脳内炎症と末梢免疫系の異常の共通の祖先を探すことになります。本研究では、原因のわからない自閉症のモデルとして、自然発症のBTBRマウスを用いました。
研究の内容
BTBRマウスの一細胞RNAシーケンス (sc-RNA seq) により、免疫異常の起源を卵黄嚢 (YS) と大動脈-生殖腺-中腎 (AGM) の胚の段階まで遡り、マクロファージ (ミクログリア) と末梢免疫細胞が分化している場所を特定しました。YSとAGMにおける二次造血*12の一細胞レベルの解析により、発生初期段階における希少な前駆細胞内の分子レベルでの病理学的メカニズムを特定することに成功しました。すなわち、これらの病態の根底にヒストン脱アセチル化酵素であるHDAC1を介した転写制御の共通メカニズムを見いだしました (図1、2)。

a: 実験概略図。胎児期の卵黄嚢及びAGMから細胞を単離して、次世代シーケンサーでそれらの転写物の配列を決定する。
b: AGM前駆細胞の一細胞解析による細胞群を示す。
c: bの3つの細胞群 (6, 12, 17) で発現上昇したトップ10の遺伝子群のヒートマップ。
d: 血管内皮細胞が造血幹細胞を産生する過程 (endothelial-to-hematopoietic transition, EHT) に必須の転写因子RUNX1のタンパク相互ネットワークに基づく遺伝子エンリッチメント解析。
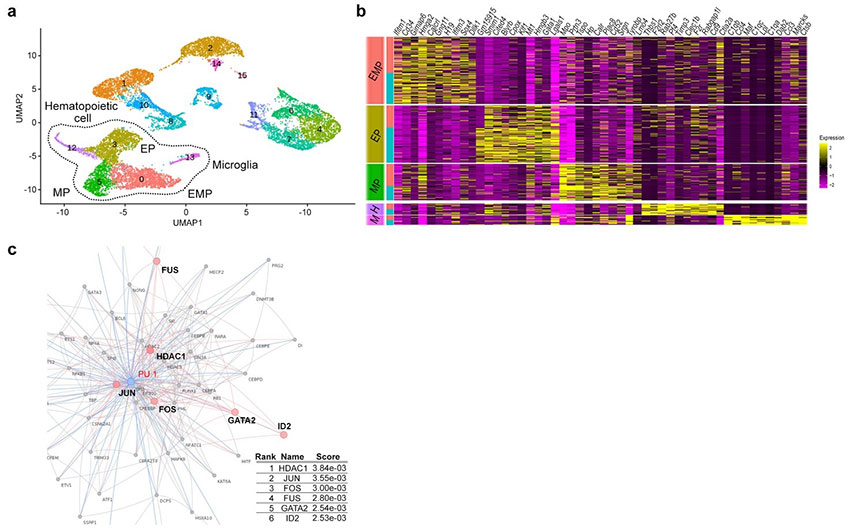
a: 卵黄嚢の一細胞解析による細胞群を示す。
b: aの5つの細胞群で発現上昇したトップ10の遺伝子群のヒートマップ。
c: ミクログリアの発達に重要な転写因子PU.1のタンパク相互ネットワークに基づく遺伝子エンリッチメント解析。
また、特定の発生段階においてエピジェネティックな機構を操作することで、脳や末梢組織における免疫異常を回復させることができることを示しました。すなわち、共通のメカニズムとして同定したヒストン脱アセチル化酵素HDAC1の阻害剤 (酪酸ナトリウム、ロミデプシン) をBTBRマウスの胎児期に投与すると、炎症性サイトカイン*13の上昇やミクログリアの活性化が抑制されました (図3)。
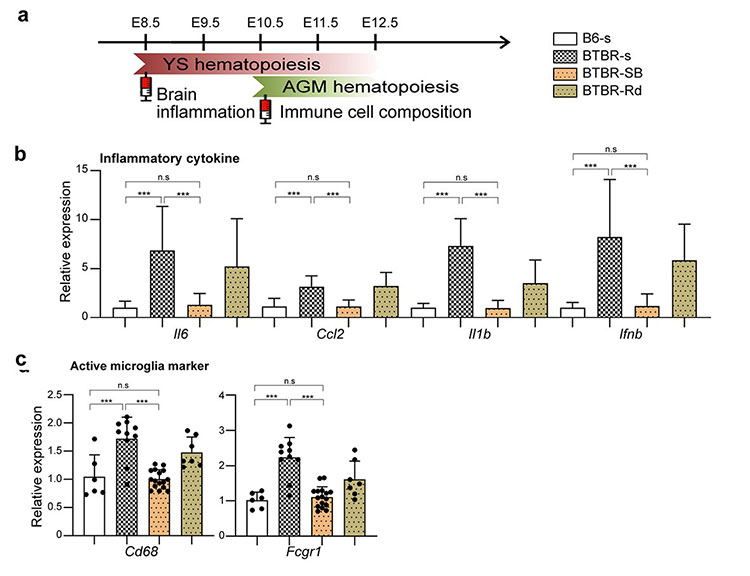
a: 卵黄嚢及びAGMの一次造血の開始時期にあたるそれぞれ胎児期8.5日、10.5日に阻害剤、酪酸ナトリウム (SB) あるいはロミデプシン (Rd) を投与したものをコントロールの生理食塩水 (s) を投与した群と比較した。
b: BTBRの脳内の炎症性サイトカイン (Il6, Ccl2, Il1b, Ifnb) の上昇が抑制された。
c: 活性化ミクログリアのマーカー (Cd68, Fcgr1) の上昇が抑制された。
さらに、免疫異常が自閉症モデルマウスの特定のプロファイルの腸内細菌の異常を決定するという因果関係を明らかにし、免疫細胞 (Treg) と腸内細菌のバイオマーカーが免疫異常を有する自閉症のサブタイプを分類する手段となる可能性があることを明らかにしました。
以上から、自閉症に見られる脳と腸などの末梢臓器での異常は、免疫細胞の祖先である造血幹細胞系のエピジェネティックな異常によって引き起こされることがわかりました (図4)。

ヒストン脱アセチル化酵素1 (HDAC1) の促進による転写抑制は、血管内皮細胞から造血幹細胞の産生への過程 (EHT) に影響を与える。卵黄嚢 (Yolk sac) の赤血球?骨髄球系前駆細胞 (EMP) はミクログリアを活性化して脳内炎症に影響する。AGMの前造血幹細胞 (pre-HSC) は骨髄 (BM) にて分化、変化を受けた免疫系は腸内細菌叢に影響を与える。
今後の展開
今回の研究成果は、自閉症における全身性免疫異常という長年の謎を明らかにしただけでなく、環境リスク要因の異なる自閉症モデルに共通する病因としてエピジェネティックな障害が果たす役割を示唆するものです。さらに、将来的に自閉症の精密医療、個別化医療を発展させるためには、発症メカニズムに応じた自閉症のサブタイプ分類が必要であり、自閉症治療の新たな道を切り開く重要な第一歩となります。
用語解説
- *1 特発性自閉症
- 自閉症は遺伝要因と環境要因による複合性疾患であると考えられる。これまでに、遺伝子変異やゲノム異常などの遺伝的要因が原因であることが知られているが、未だ多くの自閉症は原因が不明である。環境要因も含めてこれら原因の特定できない自閉症を特発性自閉症とよんでいる。
- *2 エピジェネティクス
- ゲノム情報以外の遺伝様式で、DNAのメチル化やヒストンタンパク質の化学修飾によって、ゲノム情報が同じでも遺伝子発現が異なる遺伝様式のことをさしている。
- *3 神経発達症
- 脳の機能的な問題が関係して生じる疾患で、従来発達障害と呼ばれてきたもの。
- *4 BTBRマウス
- マウスの類遺伝子系統の一つで、マウス系統の体系的な行動解析から、いわゆる自閉症様行動に最も近い系統と報告された。いわば、特発性自閉症のマウスモデルと言える。
- *5 AGM
- 大動脈-生殖腺-中腎で、胎児造血の場である。
- *6 一細胞RNA-seq
- 次世代シーケンサーを用いることで、個々の細胞が保持しているmRNA全体を質的、量的に網羅的に調べる方法。次元圧縮法などの数理的解析と組み合わせることで、遺伝子発現の状態に基づいた細胞の分類を行うことが可能になり、細胞状態の推定が可能になる。また、遺伝子発現プロファイルの変化に基づく擬時系列解析によって、発達に伴う細胞状態の繊維の描写ができる。
- *7 HDAC1
- ヒストン脱アセチル化酵素1でヒストンタンパク質を修飾することで遺伝子発現を調節する。
- *8 卵黄嚢
- 妊娠期における卵黄を包む膜状の嚢で、胎児造血 (一次造血) の場でもある。
- *9 ミクログリア
- 中枢神経系グリア細胞の一つで、中枢の免疫担当細胞として知られ、中枢神経系に存在する常在性マクロファージとも呼ばれる。他のグリア細胞 (アストロサイトやオリゴデンドロサイトなど) とは異なり、胎生期卵黄嚢で発生する前駆細胞を起源とする。
- *10 腸内細菌叢
- 腸内に存在する細菌の塊で、腸内フローラとも呼ばれる。最近は次世代シーケンサーを用いた細菌のメタゲノム解析により研究が進歩し、自閉症を含むさまざまな疾患との関連が示唆されている。
- *11 脳腸軸
- 脳と腸との連関で脳腸相関とも呼ばれる。脳と腸は自律神経系や液性因子 (ホルモンやサイトカインなど) を介して、双方向に関連している。最近は、腸のマイクロバイオーム (微生物叢) と脳との間の相互作用の連絡システムが注目されている。
- *12 ニ次造血
- 胎生期の造血は、卵黄嚢で一次造血が始まり、AGMにおいて、ニ次造血が起こる。その後肝臓において、最終的には骨髄にて、その後生涯にわたって造血が続く。
- *13 炎症性サイトカイン
- 免疫系細胞から分泌されるタンパク質で、炎症症状を引き起こすサイトカイン。
謝辞
本研究は、日本学術振興会科学研究費補助金基盤研究 (S)、日本医療研究開発機構「脳とこころの研究推進プログラム (精神?神経疾患メカニズム)」、武田科学振興財団研究助成などによる支援を受けて行いました。
論文情報
- タイトル
- “A common epigenetic mechanism across different cellular origins underlies systemic immune dysregulation in an idiopathic autism mouse model”
- DOI
- 10.1038/s41380-022-01566-y
- 著者
- Chia-Wen Lin, Dian E Septyaningtrias, Hsu-Wen Chao, Mikiko Konda, Koji Atarashi, Kozue Takeshita, Kota Tamada, Jun Nomura, Yohei Sasagawa, Kaori Tanaka, Itoshi Nikaido, Kenya Honda, Thomas J McHugh, Toru Takumi
- 掲載誌
- Molecular Psychiatry